Molekylbindning
I gasformiga grundämnen som väte och syre finns inga fria atomer. Atomerna har bildat tvåatomiga molekyler. Föreningar som vatten, ammoniak och metan innehåller fler atomer i varje molekyl.
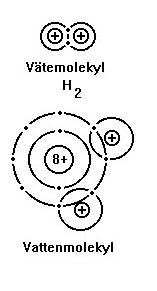
Väte har en elektron i K-skalet , men för att få ädelgasstruktur strävar det efter att få dit ytterligare en elektron. Atomerna slår sig samman parvis. Elektronerna ingår i båda atomernas skal. Atomerna har fått ädelgasstruktur. Elektronparet utgör bindningen mellan atomerna. Denna typ av bindning finns hos alla molekylföreningar och kallas för molekylbindning, elektronparbindning eller kovalent bindning.
Vattenmolekylen innehåller två elektronpar. Syre saknar två elektroner i sitt yttersta skal, och kan fånga in elektronerna från två väteatomer. På så sätt får både väte och syre sina yttersta skal fyllda.